En termodinámica, la energía libre de Gibbs (energía libre o entalpía libre) es un potencial termodinámico, es decir, una función de estado extensiva con unidades de energía, que da la condición de equilibrio y de espontaneidad para una reacción química (a presión y temperatura constantes).
La segunda ley de la termodinámica postula que una reacción química espontánea hace que la entropía del universo aumente, ΔSuniverso > 0, así mismo ΔSuniverso esta en función de ΔSsistema y ΔSalrededores. Por lo general sólo importa lo que ocurre en el sistema en estudio y; por otro lado el cálculo de ΔSalrededores puede ser complicado.
Por esta razón fue necesaria otra función termodinámica, la energía libre de Gibbs, que sirva para calcular si una reacción ocurre de forma espontánea tomando en cuenta solo las variables del sistema.
Cálculo de la energía libre

donde H es la entalpía ; T es la temperatura y S es la entropía del sistema. Fue desarrollada en los años 1870 por el físico-matemático estadounidense Williard Gibbs.
Cambios de energía libre estándar
La energía libre de reacción, se denota, , es el cambio de energía en una reacción a condiciones estándares. En esta reacción los reactivos en su estado estándar se convierten en productos en su estado estándar.
, es el cambio de energía en una reacción a condiciones estándares. En esta reacción los reactivos en su estado estándar se convierten en productos en su estado estándar.
Dada la siguiente ecuación química:
La energía libre se calcula como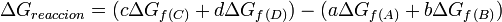
Donde A y B son los reactivos en estado estándar y; C y D son los productos en su estado estándar. Además a, b, c y d son sus respectivos coeficientes estequiométricos.
en general:
donde ni y mj son la multiplicación de los coeficientes estequiométricos.
Así como en el cálculo de la entalpía, en la energía libre estándar de formación para cualquier elemento en su forma estable (1 atm y 25ºC) es 0
La energía de Gibbs molar de reacción se puede relacionar de manera conveniente con la constante de equilibrio de la reacción según la siguiente ecuación:
La variación de energía libre de Gibbs para un proceso a temperatura y presión constantes viene dada por:
La temperatura puede ser un factor determinante a la hora de hacer que un proceso sea espontáneo o no lo sea.
Significado de
La condición de equilibrio es
La condición de espontaneidad es
El proceso no es espontáneo cuando:
La energía de Gibbs molar parcial, es lo que se conoce con el nombre de potencial químico, que es lo que se maneja en cálculos termodinámicos en equilibrio, ya que el equilibrio químico entre dos sistemas implica la igualdad de potenciales químicos y su uso facilita los cálculos.

donde H es la entalpía ; T es la temperatura y S es la entropía del sistema. Fue desarrollada en los años 1870 por el físico-matemático estadounidense Williard Gibbs.
Cambios de energía libre estándar
La energía libre de reacción, se denota,
 , es el cambio de energía en una reacción a condiciones estándares. En esta reacción los reactivos en su estado estándar se convierten en productos en su estado estándar.
, es el cambio de energía en una reacción a condiciones estándares. En esta reacción los reactivos en su estado estándar se convierten en productos en su estado estándar.Dada la siguiente ecuación química:

La energía libre se calcula como
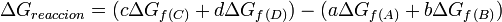
Donde A y B son los reactivos en estado estándar y; C y D son los productos en su estado estándar. Además a, b, c y d son sus respectivos coeficientes estequiométricos.
en general:

donde ni y mj son la multiplicación de los coeficientes estequiométricos.
Así como en el cálculo de la entalpía, en la energía libre estándar de formación para cualquier elemento en su forma estable (1 atm y 25ºC) es 0
La energía de Gibbs molar de reacción se puede relacionar de manera conveniente con la constante de equilibrio de la reacción según la siguiente ecuación:

La variación de energía libre de Gibbs para un proceso a temperatura y presión constantes viene dada por:

La temperatura puede ser un factor determinante a la hora de hacer que un proceso sea espontáneo o no lo sea.
Significado de

La condición de equilibrio es

La condición de espontaneidad es

El proceso no es espontáneo cuando:

La energía de Gibbs molar parcial, es lo que se conoce con el nombre de potencial químico, que es lo que se maneja en cálculos termodinámicos en equilibrio, ya que el equilibrio químico entre dos sistemas implica la igualdad de potenciales químicos y su uso facilita los cálculos.
http://3.bp.blogspot.com/-4lr4AJ59DLk/T8w0kQn8xqI/AAAAAAAAADs/8u8a9-DgoKs/s1600/44444.bmp



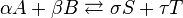







![K_c=\frac{[S]^\sigma [T]^\tau } {[A]^\alpha [B]^\beta}](http://upload.wikimedia.org/math/a/f/6/af61c8307fbde1f9595004610ce90563.png)





.jpg)
.jpg)
 . Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como
. Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como 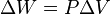 , donde
, donde  es la presión (el trabajo es positivo, ya que es ejercido por el sistema).
es la presión (el trabajo es positivo, ya que es ejercido por el sistema). , el cambio de la energía interna del sistema es:
, el cambio de la energía interna del sistema es: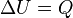
 . Si la cantidad de gas permanece constante, entonces el incremento de energía será proporcional al incremento de temperatura,
. Si la cantidad de gas permanece constante, entonces el incremento de energía será proporcional al incremento de temperatura,
 es el calor específico molar a volumen constante. En un diagrama P-V, un proceso isocórico aparece como una línea vertical
es el calor específico molar a volumen constante. En un diagrama P-V, un proceso isocórico aparece como una línea vertical donde
donde  es un número dado. Para el caso de procesos adiabáticos,
es un número dado. Para el caso de procesos adiabáticos,  , el cual es un valor específico para cada sustancia. Este valor se puede encontrar en tablas para dicho caso.
, el cual es un valor específico para cada sustancia. Este valor se puede encontrar en tablas para dicho caso..jpg)


 ..........(1)
..........(1)
 se puede expresar en función de la presión que se ejerce el gas, y el desplazamiento
se puede expresar en función de la presión que se ejerce el gas, y el desplazamiento  se puede escribir como dx, entonces:
se puede escribir como dx, entonces:
 ..........(2)
..........(2) ..........(3)
..........(3) ..........(4)
..........(4)

![[Q]_1^2 = [U]_1^2 + nRT[\ln V]_1^2](http://upload.wikimedia.org/math/9/b/b/9bb7def5b45c1c793290a37d2aafc98d.png)

 ..........(5)
..........(5)

